Charakteristische Röntgenstrahlung
Physik
© 2016
- 2025
Basiswissen|
Was ist die charakteristische Röntgenstrahlung?|
Wie entsteht die Strahlung?|
Was ist charakteristisch an der Strahlung?|
Was bedeuten K-Alpha, L-Beta und so weiter?|
Fallbeispiel Kupferanode|
Relevanz|
Persönliche Anmerkung|
Fußnoten
Basiswissen
Eine von zwei Arten von Röntgenstrahlung: Röntgenstrahlung besteht aus sehr energiereichen Photonen (Quanten). Diese Photonen stammen niemals aus einem Atomkern. Sie entstehen immer durch Elektronen außerhalb des Kerns. Es werden zwei Arten der Entstehung unterschieden: Bremsstrahlung und die charakteristische Strahlung. Letztere wird hier kurz vorgestellt.
Was ist die charakteristische Röntgenstrahlung?
- Das ist Röntgenstrahlung die aus Elektronenübergängen in Atomhüllen entsteht.
- Nur so entstandene Strahlung nennt man charakteristisch.
- Sie ist ein Linienspektrum der Röntgenstrahlung.
- Jedes chemische Element hat ein eigenes Spektrum.
Wie entsteht die Strahlung?
- Elektronen in Atomhüllen können verschiedene Energieniveaus einnehmen.
- Statt von Energieniveaus spricht man hier auch von Schalen.
- Schalen nah am Atomkern nennt man innere Schalen.
- Zunächst wird ein Elektron aus einer inneren Schale herausgeschlagen.
- Dadurch ist ein Elektronen-Platz einer inneren Schale frei geworden.
- Ein Elektron einer äußeren Schale fällt dann auf diesen Platz "herunter".
- Bei diesem Herunterfallen sendet das fallende Elektron ein Röntgenphoton aus.
- Das fallende Elektron kann dabei aus verschiedenen der äußeren Schalen stammen.
- Je größer die Fallhöhe des Elektrons, desto energiereicher ist das erzeugte Photon.
- Der Energieinhalt eines Photons ist proportional zu seiner Wellenlänge.
- So entstehen also Röntgenstrahlen mit unterschiedlichen Energieniveaus.
- Für jede Fallhöhe ein bestimmtes Energienievau bzw. eine bestimmte Freuquenz.
- Zur Umrechnung Frequenze-Energie, siehe auch 👉 Photonenenergie
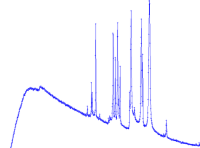
Was ist charakteristisch an der Strahlung?
- Charakteristisch heißt so viel wie: typisch für
- Die Strahlung ist typisch für bestimmte chemische Elemente.
- Die Spitzen (Peaks) liegen für jedes Element bei anderen Frequenzen.
- Kennt man die Frequenzen, die spitze Peaks ergeben, dann kann ...
- man daraus auf das erzeugende Element Rückschlüsse ziehen.
Was bedeuten K-Alpha, L-Beta und so weiter?
- Diese Bezeichnung beinhaltet zwei Informationen:
- Sie beginnt mit einem Großbuchstaben: K, L, M, N, O etc.
- Das gibt an: aus welcher Schale wurde ursprünglich ein Elektron entfernt
- Auf diese Schale fällt dann anschließend auch ein Elektron von oben hinein.
- Der zweite Buchstabe ist immer ein grieschischer: alpha, beta, gamma etc.
- Er gibt an: wie viele Schalen fällt das obere Elektron nach unten
- K-alpha heißt also: Ursprünglich wurde ein Elektron aus der K-Schale geschlagen.
- Dann fiel ein Elektron eine Schale nach unten und füllte die Lücke wieder auf.
- Dieses fallende Elektron stammte damit also aus einer Schale höher als die K-Schale.
- Das herunterfallende Elektron stammte also aus der L-Schale.
- Zielschale ist K, Herkunft eins darüber 👉 K-alpha Strahlung
- Zielschale ist K, Herkunft zwei darüber 👉 K-beta Strahlung
- Zielschale ist L, Herkunft eins darüber 👉 L-alpha Strahlung
- Zielschale ist K, Herkunft zwei darüber 👉 L-beta Strahlung
Fallbeispiel Kupferanode
Die bisher nur stichpunktartigen Erläuterungen sollen jetzt am Beispiel einer Röntgenröhre mit Kupferals Anodenmaterial in etwas mehr Zusammenhang betrachtet werden. [1]
Kupferatom
Beim Kupferatom sind die inneren K-, L- und M-Schalen im Sinne des Schalenmodells [2] voll besetzt. In der N-Schale als äußerste Schale befindet sich nur ein Elektron.
- Die K-Schale ist mit zwei Elektronen besetzt.
- Die L-Schale ist mit mit acht Elektronen besetzt.
- Die M-Schale ist mit achtzehn Elektronen besetzt.
- Die N-Schale ist mit einem Elektron besetzt.
- Die O-Schale ist im Grundzustand nicht mit Elektronen besetzt.
- Die O-Schale ist im Grundzustand nicht mit Elektronen besetzt.
Ein Kupferatom mit der Ordnungszahl 29 hat für jedes seiner 29 Protonen im Atomkern genau ein Elektron in seiner Atomhülle. Die Elektronen der Atomhülle verteilen sich dabei nach den Regeln des Pauli-Prinzips auf die einzelnen Schalen des Atoms. Diese Regeln sind im klassischen Schalenmodell mit abgebildet.
Leuchteffekte
Man kann das Metall Kupfer zum Leuchten bringen, ohne dass dabei Röntgenstrahlung entsteht. Optische Spektren, die man zum Beispiel durch einen Lichtbogen zwischen Kupferelektroden erzeugen kann, regen nur das äußerste Elektron auf der N-Schale an. Dieses Elektron bezeichnet man entsprechend auch als Leuchtelektron. Dieses Elektron springt dann von der N-Schalen noch weiter weg vom Kern. Damit ist das Kupferatom in einem sogenannten angeregten Zustand. Fällt das Elektron wieder zurück in seine ursprüngliche N-Schale sendet es dabei ein Photon im sichtbaren Bereich des Lichts aus. Die Energieunterschiede zwischen den äußeren Schalen des Atoms sind allesamt so gering, dass dabei niemals ein Phton als Röntgenquant ausgesendet wird.
Energiebedarf
Röntgenstrahlung besteht aus sehr energiereichen Photonen, auch Quanten genannt. Wenn beim Fall eines Elektrons von einer höhere auf eine niedriegere Energiestufe, das heißt auch Schale, ein Röntgenquant freigesetzt werden soll, dann muss der Energieunterschied zwischen den Stufen entsprechend groß sein. Hier hilft das Bohrsche Atommodell als bildhafter Hintergrund. [3] Ausreichend große Energieunterschiede gibt es nur bei den inneren Schalen.
Ionisierung
Quanten oder Photonen von Röntgenstrahlung können also nur entstehen, wenn ein Elektron einer inneren Schale, etwa der K-Schale, entfernt wird. Nur dann kann ein Elektron aus einer höheren Schale auf diese freie Schale herunterfallen und dabei ein energiereiches Röntgenquant aussenden. Um ein Elektron aus der K-Schale eines Kupferatoms zu entfernen benötigt man eine Energie von 11400 Elektronenvolt. Eine Röntgenröhre, die eine Beschleunigungsspannung von zum Beispiel 12000 Volt hat, kann entsprechende Elektronen liefern. Ein so energiereiches beschleunigtes Elektron dringt durch die Atomhülle bis in die inneren Schalen vor und schlägt dort dann zum Beispiel ein Elektron der K-Schale heraus. Das Atom ist damit auch ionisiert, das heißt, es hat jetzt nicht mehr gleich viele Elektronen in der Hülle wie es Protonen im Kern hat. Es ist elektrisch nicht mehr neutral. Das aber ist für die Entstehung der Röntgenstrahlung nebensächlich. Wichtig ist: auf einer der innersten Schalen, etwa der K-Schale fehlt ein Elektron, dort ist eine Lücke.
Röntgenquant
Nun fehlt auf einer der untersten Schale, der K-Schale, ein Elektron. Daraufhin fällt ein Elektron aus einer höheren Schale, etwa der L-Schale, nach unten. Da das Atom dadurch in einer energieärmeren Zustand überführt wird, kann ein Röntgenquanten mit genau dieser Energiedifferenz das Atom verlassen. Die auf der L-Schale entstandene Lücke kann dann durch ein wieder höher gelegenes Elektron aus der M- oder aus der N-Schale aufgefüllt werden. Dieser kaskadenartige Vorgang endet, wenn eine Lücke in einer der äußeren Schalen durch ein Elektron aus der Umgebung des Kupferartoms besetzt wird. Damit ist das Atom am Ende auch wieder elektrisch neutral.
Serien
Das Kupferatom kann Röntgenquanten mit durchaus sehr unterschiedlichen Photonenenergien aussenden. Diese unterschiedlichen Energien werden dann als Spektrallinien mit unterschiedichen Frequenzenoder Wellenlängen in einem Spektrum sichtbar. Man bezeichnet die Linien zunächst nach der untersten Schale, in die ein Elektron fällt. So kommt man zu Namen wie K-Serie, L-Serie oder M-Serie. Dann gibt man innerhalb der Serien an, von wie vielen Stufen darüber das Elektron heruntergefallen ist. Dazu benutzt man die kleinen Buchstaben des griechischen Alphabets als tiefgestellte Indizes:
K-Serie
- Kα -> Elektron fällt von der L-Schale eins nach unten in die K-Schale
- Kβ -> Elektron fällt von der M-Schale zwei nach unten in die K-Schale
- Kγ -> Elektron fällt von der N-Schale drei nach unten in die K-Schale
L-Serie
- Lα -> Elektron fällt von der M-Schale eins nach unten in die L-Schale
- Lβ -> Elektron fällt von der N-Schale zwei nach unten in die L-Schale
- Lγ -> Elektron fällt von der O-Schale drei nach unten in die L-Schale
M-Serie
- Mα -> Elektron fällt von der N-Schale eins nach unten in die M-Schale
- Mβ -> Elektron fällt von der O-Schale zwei nach unten in die M-Schale
- Mγ -> Elektron fällt von der P-Schale drei nach unten in die M-Schale
Aufspaltung
Genauerer Untersuchungen der Spektrallinien haben gezeigt, dass diese noch einmal in sich aufgespalten sind. Innerhalb einer Schale gibt es noch einmal mehrere unterschiedliche Energiestufen:
- Die K-Schale hat nur eine Energiestufe.
- Die L-Schale hat 3 Energiestufen.
- Die M-Schale hat 5 Energiestufen.
- Die N-Schale hat 7 Energiestufen.
- Die O-Schale hat 5 Energiestufen.
- Die P-Schale hat 3 Energiestufen.
Für jede dieser Energiestufen innerhalb einer Schale benötigt man auch leicht unterschiedliche Ionisierungsenergien. Eine Übersicht zu den erlaubten Übergängen zwischen den verschiedenen Energieniveaus nennt man ein 👉 Termschema
Relevanz
Neben der reinen Forschung gibt es auch eine große Anzahl von sehr praktischen Anwendungen künstlich erzeugter Röntgenstrahlung. In der Medizin möchte man damit vor allem Gewebe "photographieren". An Flugplätzen durchleuchtet man Gepäck. Im Bergbau und verwandten Industrien dienen Röntgengeräte der Analyse von Mineralien. Die charakteristische Strahlung wird dann auch praktisch interessant, wenn man einmal verstanden hat, dass die Eindringtiefe der Strahlung in Materie von der Wellenlänge abhängt: je höhre die Photonenenregie, desto größer ist die Eindringtiefe. Hat man nun dichtes Material, so sind oft hohe Eindringtiefen sinnvoll. Ist das Material eher weniger dicht und mit geringen Dichtekontrasten würden aber Photonen mit hoher Energie (kleine Wellenlänge) einfach weitgehend ganz hindruchgehen. Dort ist es dann also interessant, Photonen mit niedrigeren Energien einzusetzen. Für jede Anwendung kann man dann ganz speziell das Anodenmaterial auswählen, dass die optimal passende Wellenlänge liefert.
Persönliche Anmerkung
 Wer sich für industrienahe Anwendungen der Theorie interessiert, kann im Internet leicht viele Produktangaben von Herstellern von Röntgenröhren (X-ray tubes) finden. In den Produktangaben findet man dann oft auch genau die Darstellungen, die auch in Schulbüchern verwendet werden. Oft findet man das typische Diagramm mit dem Röntgenspektrum mit seiner Brems- und seiner charakteristischen Strahlung.Interessant ist auch, welche Bauteile für Röntgengeräte einzeln verkauft werden. Und ein Besuch der Webseiten von Herstellern kann auch eine Ahnung davon geben, welche beruflichen Tätigkeiten rund um Röntgenröhren es geben könnte: Entwickeln planen sie, Handwerker und Werkzeugmaschinenbauer setzen die Planungen um, Vertreter versuchen die Produkte den Kunden schmackhaft zu machen. Dann muss es einen Service rund um Wartung und Reparatur geben. Fachleute der technischen Dokumentation (eigener Studiengang) stellen gute Erklärungen her. Und noch viel weiter so. Gute Stichworte für eine Recherche sind zum Beispiel: X-ray, Produktinformation, Anodenmaterial.
Wer sich für industrienahe Anwendungen der Theorie interessiert, kann im Internet leicht viele Produktangaben von Herstellern von Röntgenröhren (X-ray tubes) finden. In den Produktangaben findet man dann oft auch genau die Darstellungen, die auch in Schulbüchern verwendet werden. Oft findet man das typische Diagramm mit dem Röntgenspektrum mit seiner Brems- und seiner charakteristischen Strahlung.Interessant ist auch, welche Bauteile für Röntgengeräte einzeln verkauft werden. Und ein Besuch der Webseiten von Herstellern kann auch eine Ahnung davon geben, welche beruflichen Tätigkeiten rund um Röntgenröhren es geben könnte: Entwickeln planen sie, Handwerker und Werkzeugmaschinenbauer setzen die Planungen um, Vertreter versuchen die Produkte den Kunden schmackhaft zu machen. Dann muss es einen Service rund um Wartung und Reparatur geben. Fachleute der technischen Dokumentation (eigener Studiengang) stellen gute Erklärungen her. Und noch viel weiter so. Gute Stichworte für eine Recherche sind zum Beispiel: X-ray, Produktinformation, Anodenmaterial.Fußnoten
- [1] Die exemplarische Betrachtung einer Röntgenröhre mit Kupferanode stützt sich auf eine sehr ausführliche Beschreibung in: Oskar Höfling: Physik. Lehrbuch für Unterricht und Selbststudium. Fünfzehnte Auflage. 1994. ISBN: 3-427-41045-5. Dort im Kapitel "8.3.8 Röntgenspektren", Seite 795.
- [2] Das Schalenmodell teilt die Elektronen der Atomhülle auf verschiedene Energieniveaus auf, die modellhaft als Schalen mit großen lateinischen Buchstaben als Namen bezeichnet werden. Siehe mehr unter 👉 Schalenmodell (Atomphysik)
- [3] Im Artikel zum Bohrschen Atommodell ist für das Zustandekommen von Röntgenstrahlung vor allem der Abschnitt über die Bohrsche Frequenzbedingung interessant. Siehe dazu unter 👉 Bohrsches Atommodell