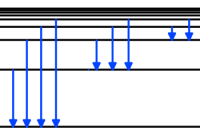
Spektrallinienserien von Wasserstoff
Auflistung
© 2016
- 2025
Basiswissen
Lyman, Balmer, Paschen, Brackett, Pfund: hier sind diese sogenannten Serien mit kurzen Daten aufgelistet.
Die Serien
- Fall auf K-Schale: 91 bis 121 nm, ultravioletter Bereich 👉 Lyman-Serie
- Fall auf L-Schale: 656 bis 365 nm, sichtbarer Bereich 👉 Balmer-Serie
- Fall auf M-Schale: 820 bis 1875 nm, infraroter Bereich 👉 Paschen-Serie
- Fall auf N-Schale: 1458 bis 4053 nm, infraroter Bereich 👉 Brackett-Serie
- Fall auf O-Schale: infraroter Bereich 👉 Pfund-Serie
Hintergrund
Wird ein Wasserstoffatom angeregt, wird damit ein Elektron aus einer der Schalen - auch Energieniveaus genannt - entfernt. Kurz darauf fällt dann ein Elektron aus einer höheren Schale auf die tiefere Schale herunter. Der Energieunterschied zwischen höherer und tieferer Schale ergibt die Wellenlänge in nm (Nanometer) des dabei ausgesandten Photons.
Naturphilosophischer Rahmen
Es ist durchaus verwunderlich, dass Atome eines bestimmten Elements immer nur Licht bestimmter Frequenzen erzeugt. Das geht aus klassischen Vorstellungen von Atomen, etwa als Miniatur-Sonnensystem gedacht, nicht logisch zwingend hervor. Noch 1927 bemerkte ein französischer Mathematiker zur Balmer-Serie des Wasserstoffs:
ZITAT:
"Eine Flamme, die mit Natriumdampf beladen ist, sendet zum Beispiel ein bekanntes gelbes Licht aus, das sich im Spektroskop in feine und helle Linien auflöst, die das Natriumatom sicherer charakterisieren als ein Foto ein menschliches Gesicht. Das Spektrum des Wasserstoffatoms mit seinen Linien, die die berühmte Balmer-Serie bilden, ist ebenfalls klassisch. In der unendlichen Skala der Lichtwellen wählt das Atom eines gegebenen einfachen Körpers ausschließlich eine bestimmte Anzahl von Noten, immer dieselben, und deren Verteilung ist oft von äußerster Komplexität. Welche Vorstellung von der Struktur des Atoms kann man sich machen, so dass diese Struktur logischerweise, durch eine rationale Konsequenz, die genaue Verteilung der Linien des entsprechenden Spektrums nach sich zieht?"
"Eine Flamme, die mit Natriumdampf beladen ist, sendet zum Beispiel ein bekanntes gelbes Licht aus, das sich im Spektroskop in feine und helle Linien auflöst, die das Natriumatom sicherer charakterisieren als ein Foto ein menschliches Gesicht. Das Spektrum des Wasserstoffatoms mit seinen Linien, die die berühmte Balmer-Serie bilden, ist ebenfalls klassisch. In der unendlichen Skala der Lichtwellen wählt das Atom eines gegebenen einfachen Körpers ausschließlich eine bestimmte Anzahl von Noten, immer dieselben, und deren Verteilung ist oft von äußerster Komplexität. Welche Vorstellung von der Struktur des Atoms kann man sich machen, so dass diese Struktur logischerweise, durch eine rationale Konsequenz, die genaue Verteilung der Linien des entsprechenden Spektrums nach sich zieht?"
Aber warum ist das? Die Antwort liegt in der Quantenphysik, wie sie erstmals von Bohr auf das Atom angewandt wurde:
ZITAT:
"Numerisch wird eine Lichtstrahlung, die einer bestimmten Spektrallinie entspricht, durch ihre Frequenz charakterisiert, das heißt durch die Anzahl der Ätherwellen, die sich an einem Punkt pro Sekunde wiederholen. Welches sind also die intrinsischen Eigenschaften des Atoms, die ihm unveränderlich diese schicksalhaften Frequenzen und die charakteristischen Zahlen, die sie ausdrücken, auferlegen? Hier kommt die Quantentheorie ins Spiel. Wenn ein Atom eine Lichtstrahlung aussendet, verliert es Energie, aber es verliert sie nicht kontinuierlich; alles läuft so ab, als ob die Natur hier sprunghaft vorgehen würde und als ob es nacheinander Energiequanten verlieren würde. Wie ein Wechselstubengeber, der sein Wechselgeld nur in Münzen herausgeben kann."
"Numerisch wird eine Lichtstrahlung, die einer bestimmten Spektrallinie entspricht, durch ihre Frequenz charakterisiert, das heißt durch die Anzahl der Ätherwellen, die sich an einem Punkt pro Sekunde wiederholen. Welches sind also die intrinsischen Eigenschaften des Atoms, die ihm unveränderlich diese schicksalhaften Frequenzen und die charakteristischen Zahlen, die sie ausdrücken, auferlegen? Hier kommt die Quantentheorie ins Spiel. Wenn ein Atom eine Lichtstrahlung aussendet, verliert es Energie, aber es verliert sie nicht kontinuierlich; alles läuft so ab, als ob die Natur hier sprunghaft vorgehen würde und als ob es nacheinander Energiequanten verlieren würde. Wie ein Wechselstubengeber, der sein Wechselgeld nur in Münzen herausgeben kann."
Es war Niels Bohr, der in den 1910er Jahren den Zusammenhang zwischen dem inneren Aufbau der Atome und den aufgenommenen und ausgesandten Lichtteilchen, den Quanten oder Photonen erstmals theoretisch zu fassen suchte. Siehe mehr unter 👉 Bohrsches Atommodell
Fußnoten
- [1] Im französischen Original von 1927: "Une flamme chargée de vapeur de sodium, par exemple, émet une lumière jaune bien connue qui se résout au spectroscope en raies fines et brillantes, caractérisant l'atome de sodium plus sûrement qu'une photographie un visage humain. Le spectre de l'atome d'hydrogène, avec ses raies formant la célèbre série de Balmer, est également classique. Dans la gamme indéfinie des ondulations lumineuses, l'atome d'un corps simple donné choisit ainsi exclusivement un certain nombre de notes, toujours les mêmes, et dont la distribution est souvent d'une complexité extrême. Quelle conception imaginer de la structure de l'atome telle que cette structure entraîne logiquement, par une conséquence rationnelle, la répartition exacte des raies du spectre correspondant?" In: Paul Painlevé: Les conceptions modernes de la matière et la science classique. Discours prononcé à Londres, le 15 novembre 1927 devant la « Royal Institution of Great Britain. Eine kurze Zusammenfassung des Vortrages wurde 1927 in Nature veröffentlicht: [News and Views]. Nature 120, 777–781 (1927). Für eine volle Textversion siehe auch 👉 Materie und klassische Physik (Vortrag)
- [2] Im französischen Original von 1927: "Numériquement, une radiation lumineuse, correspondant à une raie précise du spectre, est caractérisée par sa fréquence, c'est-à-dire par le nombre des ondulations d'éther qui se répètent en un point par seconde. Quelles sont donc les propriétés intrinsèques de l'atome qui lui imposent invariablement ces fréquences fatidiques et les nombres caractéristiques qui les traduisent ? C'est ici qu'intervient la théorie des quanta. Quant un atome émet une radiation lumineuse, il perd de l'énergie, mais il n'en perd pas d'une façon continué ; tout se passe comme si la nature procédait là par un saut, et comme s'il perdait successivement des grains d'énergie. Tel un changeur qui ne peut donner de sa monnaie que par pièces." In: Paul Painlevé: Les conceptions modernes de la matière et la science classique. Discours prononcé à Londres, le 15 novembre 1927 devant la « Royal Institution of Great Britain. Eine kurze Zusammenfassung des Vortrages wurde 1927 in Nature veröffentlicht: [News and Views]. Nature 120, 777–781 (1927). Für eine volle Textversion siehe auch 👉 Materie und klassische Physik (Vortrag)