Stoffmengenanteil
Chemie
© 2016
- 2025
Basiswissen
Wie viele Mol ein Stoff im Bezug zur insgesamt vorhandenen Molmenge hat. Wenn eine Mischung 2 Mol Salz enthält und insgesamt aus 10 Mol (Salz und anderer Stoffe) besteht, dann ist der Stoffmengenanteil 2/10 oder 20 %. Das ist hier kurz erklärt.
Definition
Ein Gemisch oder eine Lösung besteht aus verschiedenen Stoffen. Der Stoffmengenanteil x gibt an, wie viele Teilchen von einem Stoff pro Gesamtzahl an Teilchen vorhanden sind. Die übliche Einheit der Stoffmenge ist das Mol ↗
Berechnung
Man teilt die Stoffmenge des anteiligen Stoffes durch die Gesamtstoffmenge aller Stoffe. Beispiel: man hat eine Mischung aus zum Beispiel Pfefferteilchen, Salzteilchen und Zuckerteilchen. Es gibt insgesamt 2 Mol Salzteilchen. Alle Teilchen der Mischung zusammen haben 10 Mol. Dann hat das Salz einen Stoffmengenanteil von 2/10, was umgerechnet 20 % entspricht. Siehe auch Bruchzahl in Prozentzahl ↗
Einheit
Keine Einheit: der Stoffmengenanteil ist dimensionslos, das heißt, er hat keine erkennbare Einheit. Da man die Stoffmenge des anteiligen Stoffes sowie auch die Gesamtstoffmenge beide in Mol angibt, ist die Einheit eigentlich Mol pro Mol. Diese kann man gegenseitig wegkürzen, sodass die Stoffmenge nur als als Zahl, auch in Prozentschreibweise, angegeben wird. Siehe auch dimensionslos ↗
Beispiele
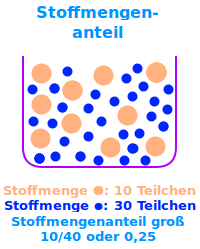
Man stelle sich eine Mischung aus 10 schwarzen und 30 weißen Kugeln vor. Der Stoffmengenanteil der schwarzen Kugeln ist 10 pro 40, als Bruch 10/40 oder kurz 1/4 oder 0,25 oder 25 %.
ppm als Stoffmengenanteil
Die Einheit ppm als parts per million gibt zum Beispiel die Stoffmenge von CO2 in der Atmosphäre als Anteil der gesamten Anzahl von Teilchen an. Siehe auch ppm ↗
Formelzeichen
- Als Formelzeichen üblich ist ein kleines lateinisches x.
- Üblich ist auch ein kleines griechisches chi χ ↗